Sommaire
Texte disponible en ligne et cité dans le livre : «La cuisine méditerranéenne métabolique : pour transformer son corps et sa santé» par Dre Èvelyne Bourdua-Roy et Sophie Rolland, neuroscientifique
La science de la longévité à connue des développements importants depuis le début des années 2000. À cette époque, il fut constaté que des animaux ayant des niveaux plus élevés d’oxydation systémique, la rouille du monde vivant, vivaient quand même beaucoup plus longtemps. Les niveaux oxydatifs, qui jouent tout de même un rôle dans la vitesse de vieillissement, ne sont pourtant pas une cause du vieillissement primaire. Il est important, pour bien comprendre le vieillissement, de le visualiser comme un processus progressif qui est relié à la base à des mécanismes cellulaires de croissance et de développement (le vieillissement primaire) qui sont influencés par nos habitudes de vie et d’autres facteurs génétiques et épigénétiques (le vieillissement secondaire).
Afin de mieux comprendre ces processus et les façons d’intervenir, je vous propose quelques explications sur les principaux aspects :
- Le continuum de santé et la longévité
- Définir gérosuppresseur et géroprotecteur
- Ce que la nature nous propose pour vivre en santé plus longtemps
- Mes dix recommandations pour vivre centenaire
1. Le continuum de santé et la longévité
Un des concept le plus important à bien comprendre est le fait que la santé s’exprime sur la base d’un continuum qui représente beaucoup plus que le fait de ne pas être malade. On se soucie, généralement au Québec, de la santé quand la maladie est installée ou en voit de se faire. Nous devrions voir la santé comme un continuum entre un état optimal et être malade. J’ai proposé 8 états dans ce continuum qui permettent de se rendre compte que notre système de la maladie ne considère que les 3 derniers : à partir de l’apparition des symptômes.
- Optimiser sa santé
- Être en santé
- Avoir un mauvais environnement de vie
- Avoir de mauvaises habitudes de vie
- Avoir des carences
- Avoir des symptômes
- Développer une maladie
- Être malade
Il est même fréquent pour des gens que l’on considère en bonne santé, de se rendre compte qu’ils ont des carences significatives et de mauvaises habitudes de vie. Ils sont quand même sur une pente descendante menant à la maladie. Ce continuum m’a fait penser de vous proposer un second continuum de paramètre biologique permettant de mieux comprendre ce qu’est le vieillissement :
- La poussée de croissance
- La distorsion dans le fonctionnement cellulaire
- La baisse graduelle des capacités de réparation
- La création de cellules sénescentes
- L’inflammation systémique reliée au vieillissement (‘’inflamaging’’)
- Le désordre métabolique (dont la dysfonction mitochondriale)
- La maladie
- La mort
Personnellement, j’ai horreur des explications qui mettent tout sur le même pied d’égalité. Dans la réalité, certaines facettes de la biologie du vieillissement en entraînent d’autres et permettent de considérer, dans une approche holistique, d’agir en amont sur les premières étapes de façon à avoir des impacts plus globaux sur la longévité en santé. Je vais donc vous expliquer ces étapes, en lien avec les marqueurs du vieillissement biologique, pour mieux situer ce qu’est le vieillissement et comment nous pouvons agir sur le processus.
a) La poussée de croissance ou la théorie de l’hyperfonction
Une première facette importante à comprendre est ce qui explique qu’une souris vieillis plus rapidement qu’un éléphant; la vitesse de développement. La taille et la vitesse de développement des organismes sont directement reliées à leur longévité. La raison est que nous vieillissons à la même vitesse que nous avons grandie. Cela explique aussi les effets de la restriction calorique sur la longévité : lorsque l’apport en calorie devient limitant, la croissance est freinée pour assurer la survie ce qui permet aussi de ralentir le vieillissement plus tard dans notre vie lorsque la croissance c’est arrêté. Notez que plusieurs bénéfices découlent de la restriction calorique. En voici quelques-uns :
– Réduction de l’inflammation et du poids corporel
– Augmentation du bon cholestérol
– Réduction des triglycérides et du mauvais cholestérol sanguin
– Réduction des risques de cancer
– Amélioration de la gestion du glucose
– Amélioration du métabolisme des mitochondries
– Réduction de la perte de masse musculaire
– Préservation des cellules souches
– Préservation de la structure et des fonctions cognitives
– Etc.
C’est ce qui fut initialement nommé la théorie de la pléiotropie antagoniste par Georges C. Williams (1926-2010) et renommé par Mikhail Blagosklonny la théorie de l’hyperfonction. Ainsi, les voies métaboliques de la croissance et du vieillissement demeurent activées même passé l’âge adulte, après l’arrêt de la croissance, et causent le vieillissement. C’est ce qui fait que le nez et les oreilles continuent leur croissance. Ainsi, nous pouvons supposer qu’un organisme vivant qui grandirait tout le temps pourrait mieux vieillir ? Et oui, c’est effectivement le cas. Le requin du Groenland peut vivre de 275 à 350 ans et il ne cesse jamais de grandir (éventuellement cela mène à d’autres facteurs qui deviennent limitants). Toutefois, pour la majorité des organismes vivants, l’arrêt de la croissance est suivi par une poussée de développement sans croissance qui cause de la distorsion dans le fonctionnement cellulaire.
b) La distorsion dans le fonctionnement cellulaire
Pour reprendre une analogie proposée par Blagosklonny : ‘’c’est comme conduire une voiture avec l’accélérateur à fond tout le temps en modérant la vitesse avec le frein : la voiture userait plus rapidement’’. Il y aurait donc deux façons de limiter l’usure : lever le pied de l’accélérateur (exemple, la souris vs l’éléphant (l’éléphant ayant moins d’accélération; un développement plus lent)) ou faire plus d’entretien. Certains organismes qui vivent particulièrement longtemps font plus d’entretien. C’est le cas du rat taupe nu et des chauves-souris. Bien qu’ils soient de la taille d’une souris, ils vivent environ 10 fois plus longtemps que les autres organismes de la même taille. Ils maintiennent de meilleures capacités de réparation, beaucoup plus longtemps au cours de leur vie.
Cette poussé constante de développement, après l’arrêt de la croissance, réduit graduellement nos capacités de réparation. Quand nous sommes jeunes, nous réparons à peu près tout, mais en vieillissant, des dommages s’accumulent parce que nos capacités de réparation diminuent. Que ce soit la réparation de l’ADN, des protéines ou des cellules, cela s’additionne à la baisse des capacités antioxydantes.
c) La baisse graduelle des capacités de réparation
Donc après l’âge adulte, les capacités de réparation baissent et c’est relié à des changements épigénétiques (la lecture et la fréquence, ou non, de certains gênes). Il s’en suit de l’instabilité génétique, un moins bon fonctionnement des cellules, de l’accumulation de débris cellulaires, un raccourcissement des télomères (les indicateurs de l’état de santé des cellules) et ultimement, une baisse du renouvellement des cellules. Les cellules non renouvelées deviennent des cellules sénescentes.
d) La création de cellules sénescentes
Les cellules ont leur propre durée de vie et de cycle/phase. Dans un système complètement fonctionnel, lorsqu’il survient un dysfonctionnement, les programmes d’entretiens ciblent ces cellules déficientes afin de les empêcher de se reproduire/dupliquer et les éliminent. Si elles ne sont pas éliminées, elles peuvent finir par se dérégler et devenir cancéreuses. Il existe un état, que l’on pourrait catégoriser de cellules zombies, qui est entre la vie et la mort : un emprisonnement pour empêcher de nuire. C’est ce que l’on appelle les cellules sénescentes.
Ces cellules s’accumulent naturellement tout au long du processus de vieillissement. Alors, plus nous vieillissons, plus il y a de cellules sénescentes : « …avec l’âge, ceci conduit à une inflammation accrue due à un phénotype sécrétoire associé à la sénescence (PSAS). Ce phénotype qui inclut plusieurs cytokines favorise les tumeurs et peut épuiser le réservoir de cellules immunitaires dans le corps. » (Traduction libre) (Thoppil & Riabowol, 2020). Donc, si les mécanismes de maintenance ne détruisent pas les cellules sénescentes et que ces cellules s’accumulent, avec le temps, elles surproduiront des molécules inflammatoires, ce qui affaiblira le système immunitaire et le corps sera plus sensible aux diverses maladies.
e) L’inflammation systémique reliée au vieillissement («inflamaging»)
Ces cellules sénescentes seraient en grande partie responsables de l’augmentation graduelle de l’inflammation en vieillissant; plus on vieillit, plus on a tendance à développer une inflammation légère et systémique (dans tout le corps). Cette inflammation légère chronique augmenterait le risque ou la vitesse de développement d’un grand nombre de maladies associées au vieillissement dont le cancer, les maladies cardiovasculaires, l’arthrose et les maladies neurodégénératives. Cette inflammation légère a aussi un impact sur le métabolisme ce qui favorise la prise de poids, la résistance à l’insuline et une baisse de l’efficacité de nos usines énergétiques cellulaires que sont les mitochondries.
f) Le désordre métabolique (dont la dysfonction mitochondriale)
Donc, à partir de problématiques du fonctionnement cellulaire, nous en sommes à des impacts métaboliques dans tout le corps humain. Il s’en suit une baisse de la capacité à produire notre énergie, une difficulté à gérer le glucose et les lipides sanguins et un risque accru de plusieurs maladies dont le diabète de type II. Selon l’état de santé de chaque personne et leurs habitudes de vie, ce désordre métabolique provoquera ou non une maladie.
g) La maladie
Les maladies associées au vieillissement sont les principales maladies graves de notre époque : les maladies du cœur, la dégénérescence nerveuse, le cancer, le diabète de type II, etc. Vous pouvez dès lors comprendre que le développement de ces maladies, qui est bien sûr influencé par une multitude de facteurs environnementaux reliés à vos habitudes et votre milieu de vie, est en grande partie dû à la poussé de l’organisme à vieillir. Certains organismes vivants n’ont pas de maladies associées au vieillissement, parce qu’ils conservent de meilleures capacités de maintenance et de réparation.
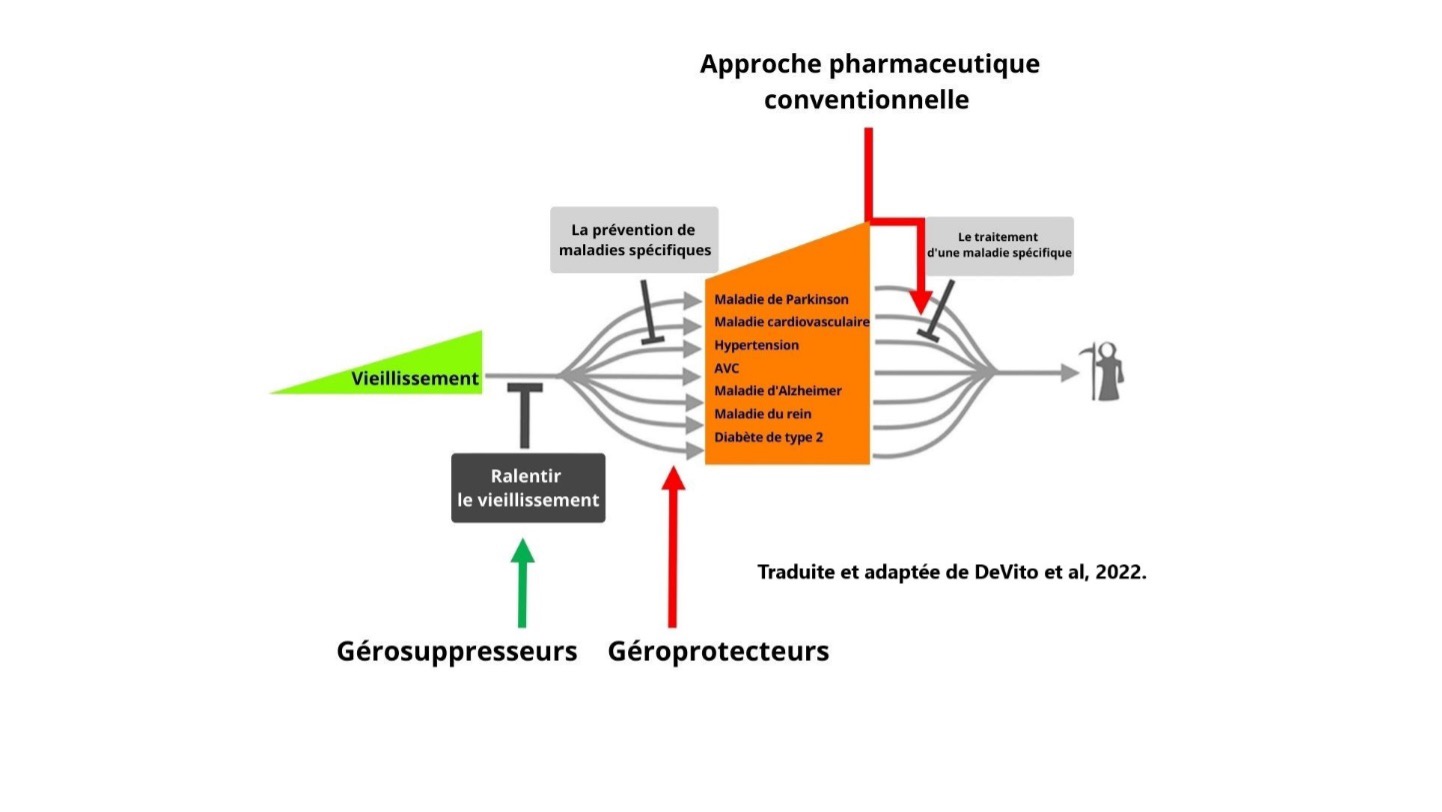
C’est pour cette raison que les gérosuppresseurs, molécules qui agissent en réduisant la poussé de l’organisme à vieillir et/ou en augmentant nos capacités de maintenance et de réparation, réduisent l’incidence de l’ensemble de ces maladies. C’est ce que le chercheur américain Matt Kaeberlein a appelé, dans la prestigieuse revue Science : ‘’L’ultime médecine préventive’’. ‘’Ultime’’, parce que vous l’aurez deviné, elles agissent sur l’ensemble des maladies avant même leur établissement. L’objectif étant bien sûr de déjouer la mort.
h) La mort
Il n’est pas encore possible de ne pas mourir et étant donné la complexité de la biologie du vieillissement, je ne crois pas que ce sera possible un jour. Toutefois, mon domaine d’expertise étant la longévité en santé, je peux vous confirmer qu’il est possible d’agir sur les processus du vieillissement. Il faut garder à l’esprit que plus nous agissons en amont sur les étapes mentionnées, plus les résultats obtenus seront importants et significatifs. Si l’on attend d’être malade pour changer nos habitudes de vie, bien qu’il ne soit jamais trop tard, il est évident que ce sera plus difficile de rétablir la santé.
2. Définir gérosuppresseur et géroprotecteur
À partir du moment où ces mécanismes cellulaires ont été relié au vieillissement, au milieu des années 2000, il fut possible de partir à la recherche de molécules qui pourraient influencer ces processus. Certaines molécules naturelles ont des effets de modulation des mécanismes impliqués dans la longévité plus élevée de certains être vivants. Elles sont très peu nombreuses. Les molécules capables de ralentir le vieillissement primaire ont été initialement nommées « mimétismes de la restriction calorique ».
Nous les appelons maintenant ces molécules des gérosuppresseurs; du grec ‘’géro’’ qui veut dire vieillissement et ‘’suppresseur’’ pour le ralentissement du processus. Ce terme représente mieux l’objectif poursuivi. Les mimétismes de la restriction calorique ne visaient pas à réduire l’apport calorique, mais a reproduire les bénéfices par le ralentissement du vieillissement primaire.
L’apport en glucide et en calories de façon générale stimule les mécanismes de la croissance et donc ceux du vieillissement. D’où l’impact de la restriction calorique ou du jeûne sur la longévité. Les gérosuppresseurs agissent aussi sur ces mêmes mécanismes (ex : polyphénols d’olives, resvératrol, fisetine, metformine, rapamycine). Ce sont des molécules capables de ralentir le vieillissement primaire et ainsi, d’agir sur toutes les étapes du continuum de longévité. Pour être certains qu’il s’agit vraiment de gérosuppresseurs, je considère nécessaire de confirmer 3 aspects :
- Ralentissement du vieillissement confirmé par des mesures cellulaires.
- Bénéfices sur de nombreuses maladies reliées au vieillissement (impact global).
- Impacts métaboliques.
Comme vous le savez maintenant, la recherche sur le vieillissement cellulaire est mon domaine d’expertise. Nous avons fait de grandes découvertes avec l’Université Concordia, qui nous ont permis d’identifier 21 nouveaux gérosuppresseurs qui proviennent tous d’extraits de plante. Ce programme de recherche, avec le support du Conseil de recherche en sciences naturelles et en génie du Canada, a mené à l’élaboration des produit Vitoli (www.vitoli.ca). Les résultats obtenus portent sur la longévité cellulaire, moyenne et maximale. Ils incluent aussi des analyses sur l’activité métabolique des mitochondries, sur l’oxydation des lipides membranaires ainsi que sur l’oxydation des protéines, de l’ADN des mitochondries et de l’ADN du noyau cellulaire. Ces extraits antivieillissements, appelés gérosuppresseurs, augmentent la résistance des cellules au stress oxydatif et à la température. L’amélioration du fonctionnement cellulaire réduit les dommages subis par les cellules tout en augmentant leur résistance face aux situations difficiles. L’impact maximal observé jusqu’à maintenant est de 7 fois plus important que celui du resvératrol seul (plus de 700% plus élevé).
Il est important de mentionner qu’il y a encore peu de gérosuppresseurs bien définis et pour lesquels des études cliniques confirment les bénéfices sur une multitudes de problématiques reliées au vieillissement et sur le métabolisme. Les mieux documentés scientifiquement sont certainement les polyphénols d’olives et le resvératrol.
En 2013, un groupe de recherche espagnol utilisa le terme ‘’gérosuppresseurs’’ pour catégoriser les multiples bénéfices santé des polyphénols d’olives en les reliant aux processus du vieillissement. Un second article, d’un autre groupe de recherche indépendant, est venu confirmer cette affirmation en 2019 par une revue de littérature très complète. En passant en revue 194 références scientifiques, l’équipe de de Pablos et ses collaborateur (2019) ont résumé à la fois les mécanismes cellulaires, les modèles animaux et les études cliniques réalisées (l’hydroxytyrosol présenté à la figure suivante étant le plus important des polyphénols d’olive). Ces effets bénéfiques des polyphénols d’olives sont à l’origine d’une grande partit des bénéfice santé de cette huile si importante pour la diète méditerranéenne.
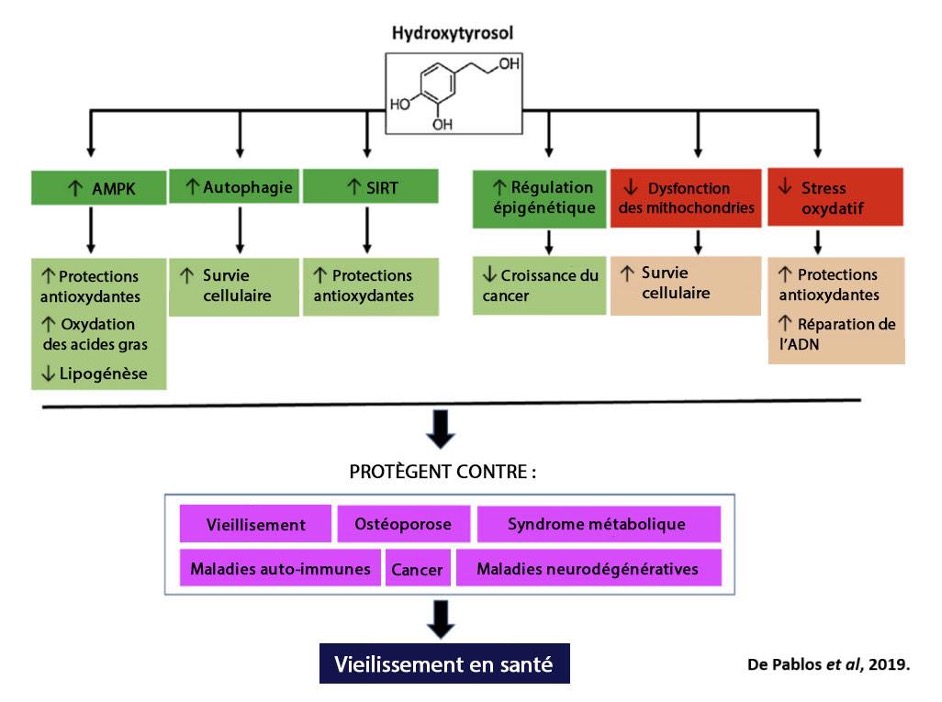
Pour ce qui est du resvératrol, qui est aussi un polyphénol important de la diète méditerranéenne, il compte à ce jour plus de 5 000 publications scientifiques. Une étude concluait que la meilleure alternative à la restriction calorique chez l’humain serait de réduire notre apport en calories, de faire de l’exercice physique régulièrement et de consommer un supplément alimentaire de resvératrol. La dose optimale de resvératrol pour un adulte (125 à 250 mg) est pratiquement impossible à prendre juste par les sources alimentaires (vin, raisins, chocolat noir, bleuets, arachides).
Il y a déjà 19 études cliniques répertoriées concernant la pharmacocinétique du resvératrol chez l’humain et plus de 250 études cliniques. Son plus haut niveau de concentration sanguine apparaît après 30 à 90 minutes. Sa demi-vie est d’environ neuf heures. Environ 70 % de la dose consommée est absorbée, mais seulement de faibles quantités de la molécule intacte sont détectables dans le sang. Le métabolisme extrêmement rapide de conjugaison (liaison à d’autres molécules) réduit de beaucoup la biodisponibilité du resvératrol. Cependant, il semble que ces mêmes métabolites (molécules conjuguées) s’accumulent dans différents tissus du corps et seraient reliés aux effets bénéfiques sur la santé. Ses impacts métaboliques sont aussi très bien documentés et ce, depuis longtemps.
Outre son action sur les sirtuines qui fut publié par le laboratoire de David Sainclair dans la prestigieuse revue Nature en 2003, le resvératrol agirait aussi sur le vieillissement par l’activation de certaines protéines impliquées dans le vieillissement primaire comme l’AMPK (AMP-activated protein kinase) et par la réduction de facteurs inflammatoires NF-κ B (nuclear factor kappa B), TNFα (Tumor necrosis factor α) et IL-6 (interleukine 6), ainsi que la diminution des radicaux libres. Une autre publication dans la prestigieuse revue Nature, a identifié un nouveau mécanisme d’action (TyrRS-PARP-1) du resvératrol qui serait 1000 fois plus sensible (activé à des quantités 1000 fois inférieures) à son action connue sur les sirtuines. Les recherches continuent.
D’un autre côté et sans aller dans les détails, certaines molécules amélioreront d’autres fonctions cellulaires ou les capacités de réparation (Ex : Co-Q10, spermidine, mélatonine) sans nécessairement ralentir le vieillissement primaire. C’est ce que l’on appel des géroprotecteurs :
- Effets protecteurs sur certains mécanismes du vieillissement.
- Bénéfices confirmés sur une ou plusieurs maladies reliées.
- Action ciblée.
3. Ce que la nature nous propose pour vivre en santé plus longtemps
Du point du vu du chercheur sur la longévité, il y a cinq grands domaines d’informations permettant d’identifier des trucs issus de la nature pour être en mesure de profiter de la vie plus longtemps : 1) l’étude des populations centenaires, 2) les gérosuppresseurs et le vieillissement cellulaire, 3) la chronobiologie, 4) la biologie comparative et 5) les études épidémiologiques. En science, on ne cherche pas à discréditer un type d’informations par rapport à un autre, mais plutôt, à tirer une connaissance globale qui permet d’avoir une vision plus juste de ce qui peut avoir un impact significatif et de comment le mettre en application. Il s’agit bien sûr de mon domaine d’expertise et c’est fascinant.
Saviez-vous que certains organismes vivants ne vieillissent pas et même, conservent des capacités de régénération exceptionnelles ? Dans le même sens, certains mammifères vivent jusqu’à 10 fois plus longtemps que les autres mammifères de leur taille, ou encore, une espèce de rongeur ne présente aucun signe de vieillissement jusqu’à un âge très avancé.
Les stratégies utilisées par les organismes qui vivent très longtemps peuvent nous donner des pistes sur ce qu’il est possible d’utiliser pour optimiser la longévité en santé de l’espèce humaine. On n’a qua penser à l’hydre; un organisme aquatique qui ne vieillit pas grâce au facteur de transcription de l’ADN FOXO dont certaines variantes, mutations, augmenteraient considérablement les chances d’atteindre 100 ans pour un humain. Un facteur de transcription est une protéine qui se lie à l’ADN pour promouvoir certaines fonctions particulières.
Chez l’humain, ce facteur de transcription se nomme FOXO3. Bien sûr, sa présence n’est pas suffisante pour permettre à elle seule la régénération des cellules à l’infini. Le facteur de transcription FOXO3 est responsable de la modulation d’un grand nombre de processus cellulaires, incluant la mort cellulaire programmée (l’apoptose), la croissance, la quiescence cellulaire et la résistance au stress par la production des enzymes antioxydantes naturelles. Plusieurs études indépendantes ont démontré qu’une variante du gène Foxo3a est surreprésentée chez des gens ayant vécu très longtemps, et ce, en Allemagne, en Chine, en Italie et aux États-Unis.
Sans entrer plus dans les détails, pour agir efficacement sur le vieillissement, il est important de considérer l’ensemble des facettes et des sources d’informations, tout en gardant en tête les effets plus importants d’agir le plus tôt possible sur le processus tel que mentionné par les 8 étapes du continuum. Les gérosuppresseurs agissent de façon globale, les géroprotecteurs à partir de l’étape 2 et 3, et il est tout de même important de considérer d’agir sur les autres étapes.
Des chercheurs développent actuellement des molécules qui agissent sur la 4e étapes; les sénolytiques (quercétine, curcumin, aspirin, NAD+, etc). Il s’agit de molécules visant à éliminer les cellules sénescentes.
Il est possible de viser les processus inflammatoires de la 5e étape en s’assurant d’avoir un bon système immunitaire, un bon microbiote intestinal et suffisamment d’oméga-3. Rendu au niveau du métabolisme, mieux vaut considérer l’ensemble des habitudes de vie que d’y aller avec la supplémentation en visant des mécanismes. Certains suppléments peuvent aider et certaines carences sont à surveiller, mais les équilibres sont tellement complexes, qu’il est facile de causer un nouveau problème en essayant d’améliorer le métabolisme (par exemple avec des médicaments).
Cette présentation par étape constitue un exercice imprécis, auquel nous pourrions ajouter des paramètres et des détails, mais il permet de comprendre comment certains processus à l’échelle cellulaires peuvent finir par influencer tout l’avenir d’un organisme vivant. Cela permet de mieux situer ce qu’est le vieillissement à la lumière des découvertes récentes.
Nous pouvons agir directement sur les processus du vieillissement primaire, la poussé de l’organisme à vieillir, afin de maintenir nos capacités le plus longtemps possible. Notez bien; ces agents gérosuppresseurs ne permettront pas de se passer des saines habitudes de vie, mais ils augmenteront vos chances d’atteindre un âge avancé en étant capable de profiter pleinement de la vie.
4. Mes dix recommandations pour vivre centenaire
Personnellement, j’en viens à la conclusion que nous pouvons augmenter nos chances avec les points suivants :
- en éliminant les glucides raffinés et en limitant l’apport en glucide,
- par la saine alimentation,
- en ayant une bonne santé métabolique,
- des périodes de jeûne,
- un programme d’activité physique varié qui inclue des exercices de haute intensité,
- des gérosuppresseurs,
- d’autres suppléments bien sélectionnés,
- une vie sociale de grande qualité,
- un respect des principes de la chorobiologie associée au métabolisme,
- une saine gestion du stress et de l’anxiété qui inclue aussi la qualité du sommeil.
Mon objectif est d’optimiser tous ces aspects afin d’ajouter de la vie à votre longévité.
Vous voulez en savoir plus? Voici d’autres articles qui pourraient vous intéresser :
- Forcer l’adaptation pour une meilleure longévité en santé
- Synergiser pour la longévité
- Vieillir en santé; c’est possible
- La personnalité pour vivre 100 ans
Références
- Austad SN, 2009. Comparative biology of aging. J Gerontol A Biol Sci Med Sci. 2009 Feb;64(2):199-201.
- Austad SN. 2010. Methusaleh’s Zoo: how nature provides us with clues for extending human health span. J Comp Pathol. 2010 Jan;142 Suppl 1(Suppl 1):S10-21.
- Baur, J.A. 2010. Resveratrol, sirtuins, and the promise of a DR mimetic. Mech Ageing Dev. Apr;131(4):261-9. Review.
- Blagosklonny MV. Answering the ultimate question “what is the proximal cause of aging?”. Aging (Albany NY). 2012 Dec;4(12):861-77.
- Blagosklonny, 2013. Big mice die young but large animals live longer. AGING, Avril 2013, Vol. 5 No 4.
- Brooks-Wilson AR. 2013. Genetics of healthy aging and longevity. Hum Genet. 2013 Dec;132(12):1323-38.
- Costantini et al, 2017. The Greenland shark: A new challenge for the oxidative stress theory of ageing? Comp Biochem Physiol A Mol Integr Physiol. 2017 Jan;203:227-232.
- de Pablos et al, 2019. Hydroxytyrosol protects from aging process via AMPK and autophagy; a review of its effects on cancer, metabolic syndrome, osteoporosis, immunemediated and neurodegenerative diseases. Pharmacological Research 143 (2019) 58–72.
- Castillo-Quan et al, 2015. Genetics and pharmacology of longevity: the road to therapeutics for healthy aging. 2015;90:1-101.
- Dakik et al, 2020. Discovery of fifteen new geroprotective plant extracts and identification of cellular processes they affect to prolong the chronological lifespan of budding yeast. 2020;11(23):2182-2203. Published 2020 Jun 9. doi:10.18632/oncotarget.27615
- Dakik et al, 2019. Pairwise combinations of chemical compounds that delay yeast chronological aging through different signaling pathways display synergistic effects on the extent of aging delay. 2019 Jan 8;10(3):313-338.
- Dakik, et al. 2020. Discovery of fifteen new geroprotective plant extracts and identification of cellular processes they affect to prolong the chronological lifespan of budding yeast. 2020;11(23):2182-2203.
- Deelen et al, 2016. Employing biomarkers of healthy ageing for leveraging genetic studies into human longevity. Exp Gerontol. 2016 Sep;82:166-74.
- DeVito et al, 2022. Extending human healthspan and longevity: a symposium report. Ann N Y Acad Sci. 2022 Jan;1507(1):70-83. doi: 10.1111/nyas.14681. Epub 2021 Sep 8. PMID: 34498278.
- Diaz-Gerevini et al, 2016. Beneficial action of resveratrol: How and why? Nutrition. 2016 Feb;32(2):174-8. doi: 10.1016/j.nut.2015.08.017. Epub 2015 Sep 25.
- Edrey et al, 2011. Successful aging and sustained good health in the naked mole rat: a long-lived mammalian model for biogerontology and biomedical research. ILAR J. ;52(1):41-53.
- Eileen M. Crimmins. 2015. Lifespan and Healthspan: Past, Present, and Promise. Gerontologist. 2015 Dec; 55(6): 901–911.
- Eric Simard, Dr en biologie. 2016. Vivre jeune plus longtemps.
- Galiniak et al, 2019. Health benefits of resveratrol administration. Acta Biochim Pol. 2019 Feb 28;66(1):13-21.
- Häsler et al, 2017. Genetic interplay between human longevity and metabolic pathways – a large-scale eQTL study. Aging Cell. 2017 Apr 19.
- Holtze et al, 2021. Alternative Animal Models of Aging Research. Front Mol Biosci. 2021 May 17;8:660959.
- Howitz KT, Bitterman KJ, Cohen HY, Lamming DW, Lavu S, Wood JG, Zipkin RE, Chung P, Kisielewski A, Zhang LL, Scherer B, Sinclair DA. Small molecule activators of sirtuins extend Saccharomyces cerevisiae lifespan. Nature. 2003 Sep 11;425(6954):191-6. doi: 10.1038/nature01960. Epub 2003 Aug 24. PMID: 12939617.
- Ismail K, Nussbaum L, Sebastiani P, Andersen S, Perls T, Barzilai N, Milman S. 2016. Compression of Morbidity Is Observed Across Cohorts with Exceptional Longevity. J Am Geriatr Soc. 2016 Aug;64(8):1583-91.
- Kaeberlein, 2015. Healthy aging: The ultimate preventative medicine. Science, 2015 Dec 4 ;350(6265) :1191-3.
- Leonov et al, 2015. Longevity extension by phytochemicals. 2015 Apr 13;20(4):6544-72.
- Longo et al, 2015. Interventions to Slow Aging in Humans: Are We Ready? Aging Cell. 2015 Aug;14(4):497-510.
- López-Otín et al, 2013. The hallmarks of aging. Jun 6;153(6):1194-217.
- Lutchman et al, 2016. Discovery of plant extracts that greatly delay yeast chronological aging and have different effects on longevity-defining cellular processes. Oncotarget. 2016 Mar 29;7(13):16542-66.
- Lutchman et al, 2016. Six plant extracts delay yeast chronological aging through different signaling pathways. Oncotarget. 2016 Aug 9;7(32):50845-50863.
- Lewis et al, 2018. A window into extreme longevity; the circulating metabolomic signature of the naked mole-rat, a mammal that shows negligible senescence. Geroscience. 2018 Apr;40(2):105-121.
- Ma et Gladyshev, 2017. Molecular signatures of longevity: Insights from cross-species comparative studies. Semin Cell Dev Biol. 2017 Oct;70:190-203.
- Medkour et al, 2019. Mechanisms by which PE21, an extract from the white willow Salix alba, delays chronological aging in budding yeast. Oncotarget. 2019 Oct 8;10(56):5780-5816.
- Menendez et al, 2013. Xenohormetic and anti-aging activity of secoiridoid polyphenols present in extra virgin olive oil. A new family of gerosuppressant agents. Cell Cycle 12:4, 555–578; February 15, 2013.
- Moskalev et al, 2017. A review of the biomedical innovations for healthy longevity. Aging (Albany NY). 2017 Jan 29;9(1):7-25. doi: 10.18632/aging.
- Newgard, C.B., Pessin, J.E. 2014. Recent progress in metabolic signaling pathways regulating aging and life span. J Gerontol A Biol Sci Med Sci. Jun;69 Suppl 1:S21-7.
- Partridge et al, 2020. The quest to slow ageing through drug discovery. Nat Rev Drug Discov. 2020 Aug;19(8):513-532.
- Peyrol et al, 2017. Hydroxytyrosol in the Prevention of the Metabolic Syndrome and Related Disorders. Nutrients 2017, 9, 306.
- Sajish and Schimmel, 2015. Human Tyr-tRNA synthetase is a potent PARP-1 activating effector target for resveratrol. Nature. 2015 Mar 19; 519(7543): 370–373.
- Seals et al, 2016. Physiological geroscience: targeting function to increase healthspan and achieve optimal longevity. J Physiol. 2016 Apr 15;594(8):2001-24.
- Shakibaei, M., Harikumar, K.B., Aggarwal, B.B. 2009. Resvératrol addiction: to die or not to die. Mol Nutr Food Res. Jan;53(1):115-28. Review.
- Singh et al, 2019. Health benefits of resveratrol: Evidence from clinical studies. Med Res Rev. 2019 Sep;39(5):1851-1891.
- Thoppil et al, 2020. A Translational Bridge Between Cellular Senescence and Organismal Aging. Front Cell Dev Biol. 2020;7:367. Published 2020 Jan 22.
- Timmers, S., Hesselink, M.K., Schrauwen, P. 2013. Therapeutic potential of resveratrol in obesity and type 2 diabetes: new avenues for health benefits ? Ann N Y Acad Sci. Jul;1290:83-9. Review.
- Tomé-Carneiro, J., Larrosa, M., González-Sarrías, A., Tomás-Barberán, F.A., García-Conesa, M.T., Espín, J.C. 2013. Resveratrol and clinical trials: the crossroad from in vitro studies to human evidence. Curr Pharm Des. 19(34):6064-93. Review.






C’est très intéressant, de vous lire.j’apprends et nourrie ma grande curiosité sur le vieillissement
Merci
Merci Manon !